|
近日,复旦大学附属儿科医院王艺教授领衔的SMA(脊髓性肌萎缩症)基因治疗研究团队,顺利完成II期临床研究的首批2例患儿入组给药。患儿经过用药后7天安全性随访,顺利出院。
3月15日,2例患儿迎来出院后的首次随访。随访结果显示:患儿四肢肌张力较用药前明显提升,CHOP-INTEND评估分数增长明显,疗效开始显现;未发生2级及以上的药物相关不良事件,安全性良好。其中一名越南籍患儿成为入组治疗的首例外籍患者,这也是我国基因治疗新药临床试验的首位国际小病友。
该名越南籍SMA患儿的父母,通过美国的家属获得研究的信息后,抱着一线希望辗转联系上复旦儿科医院王艺教授研究团队。王艺教授和研究团队第一时间给予了家属积极的反馈。研究团队面临着一系列需要解决的问题:如何让外籍患儿顺利抵达研究中心入组临床研究、如何突破研究的国界限制并符合伦理要求等。最后,在医院多方协助支持下,一系列问题得到了快速稳妥的解决,患儿家属带着期许踏上前来中国的求医之路。
抵达上海时,患儿出生已5个月零20天,距离“用药当天年龄不超过出生后第180天” 的入组条件已非常接近。“你跨越山海而来,我必倾心倾力以待”,王艺教授及团队迅速协调各方力量,加速院内流程,与时间赛跑,仅用1周时间,即完成对该名外籍患儿的筛选、入组并顺利用药。
据介绍,该临床研究自主研发的治疗1型脊髓性肌萎缩(1型SMA)的基因治疗药物EXG001-307注射液,作用机制和用法均与Zolgensma(FDA批准的第一个治疗SMA的基因疗法)相似,是一种新型的治疗1型SMA的基因替代疗法,有望一次给药长期有效。
此例外籍患儿的入组,突破了临床研究的国界限制,跨越了语言的鸿沟,打开了我国SMA基因治疗研究的国际大门,为我国的罕见病临床研究开辟新的思路和方式,也加速了罕见病药物的临床阶段,对罕见病药物的快速上市造福更多患者具有重大意义。
据介绍,随着临床研究的持续顺利推进,王艺教授的SMA研究团队已陆续在“中华医学会第二十八次全国儿科学术大会”以及美儿SMA关爱中心等官方平台汇报分享初步的试验进展。
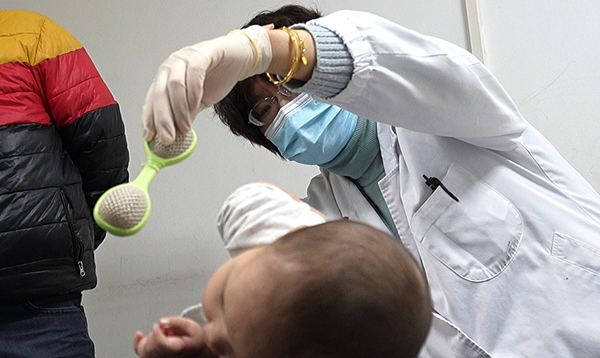
截至目前,所有接受治疗的1型SMA患儿,安全性、耐受性持续表现良好。接受治疗后的患儿,身体各项运动功能提升明显,其中有一半患儿在用药后1个月的随访中即实现了头控;最早接受治疗的患儿已经实现了无他人支撑独坐的里程碑,独站、行走等指日可待;高剂量组的首例患者在不满6月龄时已达到扶坐。现有的临床疗效和安全性数据已经让临床研究者们对EXG001-307信心十足。

目前复旦大学附属儿科医院正在进行一项治疗1型脊髓性肌萎缩的临床研究。该研究已获国家药品监督管理局批准,临床试验批准通知书编号为:2022LP00989。
目前正在为这项“一项在1型脊髓性肌萎缩患者中评估静脉注射EXG001-307后的安全性和有效性的多中心、单臂、非随机、开放性临床试验(方案编号:EXG)”招募患者;该研究预计招募9-24例1型脊髓性肌萎缩患者;该研究已获得复旦大学附属儿科医院伦理委员会批准,同意进行此项临床研究。
3)临床病史、体征符合I型SMA表现,即肌张力减退,运动功能发育滞后、头部控制不佳、圆肩姿势和关节过度活动。
5)既往使用过其他SMA治疗药物(如诺西那生纳、利司扑兰及Zolgensma等)或参加过其他SMA治疗药物的临床研究(包括但不限于上述3种药物)。
米乐6 上一篇:医学部召开临床医学学科建设推进会 下一篇:首例外籍患儿入组用药复旦儿科SMA基因治疗Ⅱ期研究



